2025-06-28
Skriv ut som pdf
7 Val av diabetesbehandling
Klassifikation
Innan man bestämmer sig för hur man ska behandla diabetes måste man ta ställning till vilken sorts diabetes vi har att göra med. Diabetes definieras endast som ett uppmätt förhöjt blodsocker men när vi ska välja behandling är det förstås avgörande att försöka förstå orsaken (patofysiologin).
T ex kräver typ 1 och pankreasinsufficens har ett absolut insulinbehov medan typ 2 ofta kan behandlas med viktreduktion, kost och andra läkemdel eftersom man ofta har tillräckligt med insulin. MODY kräver oftast ingen farmakologisk behandling. Om man har en endokrin rubbning (t ex tyreotoxikos och Cushing) ska den naturligtvis behandlas.
För definitioner och översikt se kap 1: Klassifikation.
Typ 1
1922 kunde man för första gången renframställa insulin vilket räddat livet på alla som drabbats av typ 1-diabetes. Före insulinet gick man en säker död till mötes inom 3-6 år. Man dog av svält, chock, ketoacidos eller större infektion. På bilden ser vi ett barn före och efter att insulinbehandling inletts.
Se även bilaga: "typ 1 - insulin - grundkurs"
Vad är typ 1-diabetes
Typ 1 beror på att betacellerna i bukspottkörteln som producerar insulin succesivt bryts ner och upphör att fungera. Insulin är ett anabolt hormon vilket innebär att det ser till att man kan ta tillvara energin man äter, lagra den i kroppen eller utnyttja den till förbränning.
Om man inte tillför insulin kommer istället kroppens vävnader att brytas ner till socker och fett som frisätts i blodbanan och ge upphov till ett svälttillstånd. Det höga blodsockret kommer att läcka ut i urinen och dra med sig vätska. Muskulaturen förtvinar och all energi försvinner. Man blir extremt trött och förlusten av vätska ger upphov till törst.
Efterhand utvecklas en allvarlig vätske och saltbalansrubbning med cirkulationssvikt. Fettsyrorna bryts ner till ketoner som är sura och pH-värdet sjunker. Så småningom uppstår en sk ketoacidos som är ett dödlig tillstånd som bara kan hävas med insulin.
Innan insulinet kunde framställas som ett läkemedel var typ 1-diabetes en fruktad barnsjukdom som drabbade en halv procent av befolkningen och som obönhörligen ledde till en plågsam död.
När man 1922 äntligen kunde framställa insulin trodde man att sjukdom var botad. Det visade sig dock efter några år att patienterna fick en rad mycket tråkiga komplikationer: Synskador (blindhet), njursvikt, känselrubbningar, svårläkta sår med infektioner och amputation samt om man överlevde detta hjärtinfarkt och stroke.
Det har visat sig att ett kroniskt förhöjt blodsocker ökar riskerna för komplikationer. Därför strävar vi att hålla ett så normalt blodsocker som möjligt.
Det förhöjda blodsockret är dock inte den enda förklaringen.Det finns människor som drabbas av komplikationer trots en bra kontroll och det finns de med höga sockernivåer som inte drabbas.
Vi har idag bättre och renare insuliner, bättre injektionshjälpmedel (pennor och pumpar), mer kunskap och bättre utrustning för självkontroll. Bättre behandling av andra riskfaktorer och av komplikationerna som uppstår. Prognosen för att slippa komplikationer för de som får diabetes idag är betydligt bättre än för de som fick diabetes för 30-50 år sedan då man dessutom räknade med att man i genomsnitt tappade 15 år av sitt liv.
Varför får man typ 1?
Vi har inga hållpunkter för att levnadsvanor påverkar risken att utveckla typ 1 (sockerintag, övervikt, stillasittande etc).
Typ1 diabetes är en sk ”autoimmun sjukdom” vilket betyder att det är kroppens eget immunförsvar som av någon anledning angriper våra betaceller. En aktuell hypotes är att det triggas av en enterovirus infektion (Coxsackie B) men det kan också röra sig om bakterier som tar sig upp genom gallgångarna till pankreas.
Diabetes typ 1 betraktas som en ”autoimmun sjukdom” där kroppens eget immunsystem ger sig på kroppsegen vävnad (i detta fall de insuliproducerande betacellerna i pankreas). Vissa andra autoimmuna sjukdomar är också vanligare vid typ 1: Addison, Graves, perniciös anemi, celiaki, vitiligo, alopecia sjukdomar.
Redan flera år innan blodsockerstegringen ger upphov till en diagnos kan man mäta en ökad förekomst av vissa antikroppar (GAD, IA-2A, ZnT8, ICA). Huruvida de är en del av patogenesen eller bara är en markör för den inflammatoriska processen är oklart. Alla har inte dessa antikroppar och ibland tenderar de att försvinna med åren.
Det finns en klart ärftlig grundorsak och man har också lyckats hitta vissa riskgener men om man har dem behöver man inte få diabetes och många får typ 1 utan ärftlighet eller förekomst av riskgener.
Kan man förbygga diabetes typ 1?
Det forskas mycket på möjligheten att förbygga typ 1 och det finns idag vissa läkemedel som kan fördröja utvecklingen av diabetes med ett par år hos barn som utvecklar antikroppar. Får vi fram mer och effektivare sådana läkemedel kommer vi att ställas inför uppgiften att hitta de som har hög risk för att drabbas. Troligen måste man både göra en immunologisk screening (antikroppar) och genetisk screeening (genetiska markör hos näta släktingar).
Studier pågår också med vaccinartionsprogram mot enterovirus i högriskgrupper.
Kan man bota diabetes typ 1?
Även om det är visat att alla med typ 1 faktiskt har enstaka betaceller kvar och att man har tillgång till stamceller som skulle kunna utvecklas till betaceller kan man tänka sig att försöka stimulera deras tillväxt samtidigt som man måste ha tillgång till läkemedel som dämpar immunsystemet. Detta är idag långt ifrån en lösning.
Enstaka patienter har kunnat bli insulinfria efter transplantation av betaceller. Detta gör idag endast i samband med en njurtransplantation då de immunhämmande läkemedlen ger upphov till större problem än diabetessjukdomen.
Men här går forskningen ganska fort framåt genom att genmodifiera stamceller. Men många problem återstår att lösa. Tillgång till transplantat, immunmodellering, möjlighet att döda av transplantatet ifall det växer till ohämmat.
Insulin-behandling
Typ 1 är enbart en ren insulinbristsjukdom och principen för behandlingen är att att tillföra insulin vid de tidpunkter kroppen normalt skulle ha frisatt insulin.
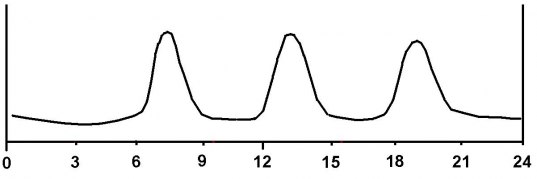
Insulin frisätts från bukspottkörteln direkt i vena porta med första effekt i levern. Effekten blir momentan och halveringstiden på insulinet är ca 6 min. Kroppen kan alltså variera insulininsöndringen momentant som svar på stigande eller sjunkande blodsocker och koncentrationen varierar kraftigt 4-6 ggr mellan högsta och lägsta värdet. Behovet ser ungefär ut så här om man äter tre gånger på en dag:
Mellan måltiderna har vi ett ständigt behov av en viss mängd insulin i blodet som bl a bromsar frisättningen av glukos från levern. När vi sedan äter behöver vi tillförsel av insulin som gör att vi lagrar upp den energi vi får i oss i måltiden. Först fylls glukosförråden (glykogen) upp i levern och sedan sockerförråden i muskulatur och njurar. Om vi äter ännu mer lagrar vi energiöverskottet som fett.
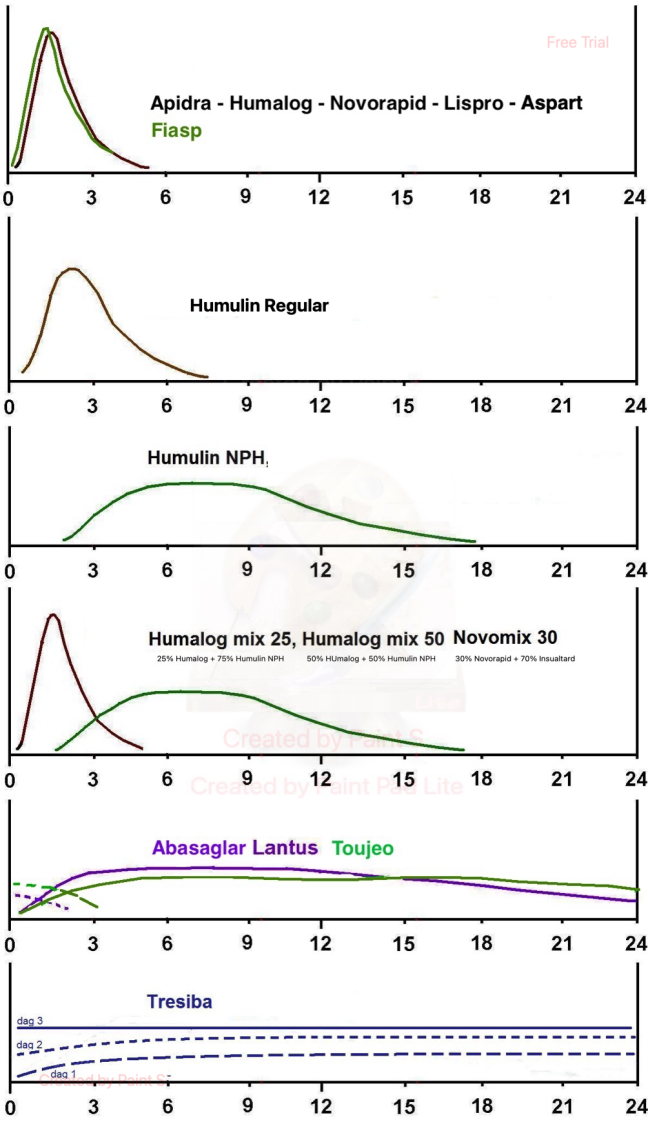
Konsten att behandla typ 1-diabetes är alltså att lära sig att tänka som en bukspottskörtel. Den basala nivån av insulin tillgodoses av basinsulinerna (Abasaglar, Lantus, Levemir, Toujeo Tresiba eller Humulin NPH) och topparna vid måltid representeras av snabbverkande måltidsinsuliner (Apidra, Fiasp, Humalog, Novorapid).
Ett alternativ är att använda en insulinpump. Den innehåller bara snabbverkande insulin (Apidra, Humalog eller Novorapid) som pumpas långsamt in i kroppen och upprätthåller en basal insulinnivå. När man sedan äter ger man sig en sk bolusdos.
För att behandla med insulin måste man alltså veta:
- När det injicerade insulinet har effekt på blodsockret
- När blodsockret är högt och när man vill ha effekten - Man måste mäta blodsocker
- Veta när och hur mycket man äter av kolhydrater och om man ska öka energiförbrukningen (t ex vid träning)
Insulinbehandling med sprutor
Nedan finns en beskrivning av de olika insulinerans effekt på blodsockret i timmar effter given injektion.
Sprutar man direktverkande insulin har det effekt först efter ca 30 min och aktiviteten håller i 3-4 timmar.
Sprutar man NPH-insulin sätter effekten in efter ca 2 timmar, maxeffekt mellan 4-10 timmar. Lantus och Abasaglar har effekt upp emot 24 timmar, Toujeo något lägre och Tresiba under flera dygn.
Läs mer: Kap 12 Insulinerna
Regelbundenhet
I teorin kan man äta hur som helst och ge insulin utifrån det. I praktiken har det dock visat sig att det är lättare att reglera sitt blodsocker om man lever ett ganska regelbundet liv. Man bör äta ungefär lika mycket på ungefär samma tider varje dag. Man bör också inta föda ungefär var 4-5.e timma och däremellan behöver en del patienter ett mellanmål i form av en frukt eller liknande (inte godis, söt läsk eller kaffebröd). Det är då lättare att ha ett jämnt blodsocker med färre känningar och samtidigt ett bra HbA1c.
Hur mycket insulin behöver man
För att hamna någorlunda rätt kan det vara bra att känna till att det dagliga insulinbehovet för en typ 1-diabetiker är ca 0,5-1,0 E/kg kroppsvikt (i tonåren upp till 2 E/kg och dygn). En person som väger 70 kg behöver med andra ord ca 50 E per dygn. Kom dock ihåg att man de första åren har en egen insulinproduktion och att behovet av injicerat insulin är mycket mindre.
"Flerdos". Måltidsinsulin och basinsulin.
BASINSULIN
Studier och erfarenheter talar för att basinsulinerna Lantus/Abasaglar, Toujeo, Levemir och Tresiba ger en jämnare basalnivå av insulin och bör vara förstahandsinsulin för typ 1-diabetiker. Basinsulinet bör i de flesta fall (om man inte äter väldigt mycket kolhydrater och är fyiskt aktiv) utgöra ungefär 40-70% av dygnsdosen insulin. En patient som väger 70 kg behöver alltså ca 20-40 E basinsulin per dag och totalt 15-35 E måltidsinsulin. Hur mycket måltidsinsulin som behövs styrs av det procentuella intaget av kolhydrater.
Lantus/Abasaglar kan i 80 % av patienterna ges en gång om dagen. Toujeo räcker troligtvis hos de allra flesta att ge i endos. Levemir behöver i 80 procent av fallen ges 2 ggr per dag. Använder man Levemir behöver man oftast en högre dos då det visat sig att det inte riktigt är "dosekvivalent".
Tresiba behöver bara tas en gång per dag vid fri tidpunkt och ger efter 2-3 dagar en jämn koncentration. Kan vara ett alternativ om Lantus/Abasaglar inte räcker dygnet runt och måste ges i tvådos eller om patienten har svårt att passa tider.
MÅLTIDSINSULIN
I princip alla patienter bör ha de nya direktverkande insulinerna som tas i anslutning till måltid (Apidra, Fiasp, Humalog Lispro eller Novorapid). Vilken måltidsdos man bör ta är beroende av:
- Insulinkänslighet
- Kolhydratinnehåll i måltiden
- Mängden mat (även fett och protein ökar insulinbehovet)
- Om man avser att vara fysiskt aktiv efter måltiden
- Aktuellt blodsockervärde
- Storlek av senaste insulindos och hur länge sedan det var man tog den (se ovan effektduration)
Lite om kolhydrater och socker
Kolhydrater är i själva verket socker (monosackarider) i kortare eller längre kedjor som tas upp till blodet och omvandlas till glukos (druvsocker) i levern. Är man fysiskt aktiv förbränner man procentuellt mycket kolhydrater i musklerna medan stillasittande personer bränner procentuellt mer fett. Högintensiv motion bränner också mer kolhydrater medan lågintensiv bränner mer fett. Hjärnan, röda blodkroppar m fl (som inte kan bränna fett) behöver ca 130 g glukos per dag vilket utgör ung 25-30% av det totala energibehovet. Detta behov kan tillgodoses av kolhydrater eller protein eftersom fett inte kan omvandlas till socker.
Vid diabetes behövs insulin för att ta upp glukos till cellerna och lagra eller förbränna det. Kolhydrater och glukos är alltså en nödvändig energikälla. Om man inte får i sig tillräckligt med kolhydrater måste vi äta mer protein för att vi inte ska börja bryta ner vårt eget protein (muskler ben och nyttig kroppsvävnad).
Det som styr insulinbehovet och lämplig insulindos vid en måltid är alltså främst kolhydratinnehållet i maten. Protein (äggviteämnen) och fett bromsar ofta sockerstegringen varför det är lämpligt att äta väl sammansatt måltider. Fett och protein i maten har dock också visat sig minska insulinkänsligheten varför även fett och protein kräver en viss mängd insulin.
Exempel på kolhydratrika livsmedel är all mjölmat, potatis, pasta, ris, socker, juice, mjölk (mjölksocker) och frukt. Består måltiden huvudsakligen av fett eller protein (kött, smör, fiberrika grönsaker) är insulinbehovet betydligt mindre.
Man kan räkna ut det ungefärliga insulinbehovet för en måltid enligt formeln 500/totala dygnsdosen (vid typ 1-diabetes). Talet man får fram är det antal gram kolhydrater som motsvarar en enhet insulin.
Exempel: Du har en dygnsdos på 50E. 500/50=10 g. Du äter 2 skivor bröd med pålägg vilket motsvarar ca 50 g kolhydrat. Insulinbehovet för att ta hand om 2 skivor bröd är alltså ca 5 E.
Dessvärre kan kolhydratkvoten vara olika under olika tider på dygnet och på morgonen brukar man behöva mer insulin och då räkna med faktorn 350 istället för 500. Kolhydrtakvoten påverkas också av andra faktorer som stress och fysisk aktivitet. Dessvärre går det aldrig att räkna ut exakt vilket insulindos man ska ta till en måltid.
Eftersom vi inte är vana att se hur många gram kolhydrat en måltid innehåller så krävs det en hel del övning. Även om man inte lär sig "räkna antalet gram" måste man lära sig vilka livsmedel som är kolhydratrika och vilka som är kolhydratfattiga och sedan genom blodsockermätningar lära sig vilka insulindoser som krävs.
Se mer om kolhydraträkning i bilagan: "typ 1 - insulin - grundkurs".
En eller två-dos mixinsulin eller NPH-insulin.
Om man inte avser att variera måltidsdoserna utifrån måltid och aktuellt sockerläge kan man som en kompromiss använda mixinsulin i 2-3 dos som ett alternativ. T ex i åldringsvården.
De nya mixinsulinerna brukar fungera bäst men dom ställer krav på att man äter samtidigt eller direkt efter att man tagit dosen eftersom den också innehåller direktverkande insulin. Humalog mix 25 innehåller 25% Humalog och 75% NPH-insulin. Novomix 30 innehåller 30% Novorapid och 70% NPH-insulin.
Det totala insulinbehovet kan variera mycket från person till person. Justeringar görs efter blodsockermätningar. Lämpligt är att mäta blodsocker minst tre gånger per dag. Morgon, före kvällsmaten samt till natten. Har man höga doser inför kvällsmaten får morgondosen ökas. Har man höga P-glukos på kvällen och höga fastevärden får man öka dosen till huvudmålet på kvällen.
Om man använder ett mixinsulin måste man äta direkt i anslutning till insulinintaget. För de som äter vissa dagar och inte andra dagar kan det vara säkrare att välja NPH-insulin i tvådos eller Lantus i endos och ge lite extra måltidsinsulin vid de tillfällen man äter.
Humalog mix 50 innehåller 50% Humalog och 50% NPH-insulin. Om man stiger mycket efter måltiderna med Mix i 2-dos och/eller tenderar att få känningar inför måltiderna eller på nätterna kan Humalog mix 50 till varje måltid vara ett alternativ. Man får då mer måltidsinsulin och mindre basinsulin.
Humalog mix 50 tar man då förslagsvis till sina huvudmåltider på dagen (2-4 ggr). Dosen kan inte varieras nämnvärt så man får se till att leva någorlunda regelbundet.
Endos Lantus/Abasaglar/Toujeo/Tresiba
Hos vissa patienter där det är svårt att förutse matintaget (äldre, begåvnningshandikappade) kan det ibland vara säkrare att bara ge en dos basinsulin på morgonen. Man får då räkna med att man ibland har lite högre värden speciellt efter måltider, fika ol. Man får då också lägga målsättningen lite högre avseende HbA1c-värde (65-75 mmol/mol).
Samtidigt ska man vara försiktig och verkligen se till så att patienten inte får nattliga hypoglykemier. För vissa patienter har Lantus för lång effekt och man bör föredra ett NPH-insulin i endos på morgonen.
Hos äldre glömska patienter med typ 1-diabetes kan Tresiba vara ett bra alternativ som basinsulin för att minska risken för ketoacidos om man glömmer en basdos.
Enklast är att ge dosen en gång om dagen. I de flesta fallen på morgonen eller förmiddagen. Man behöver inte ge insulinet i anslutning till en måltid.
Kontrollera blodsockret före varje måltid och till natten. Målet bör vara att ligga mellan 6-15 vid dessa mätningar.
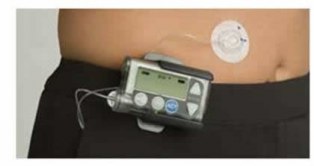
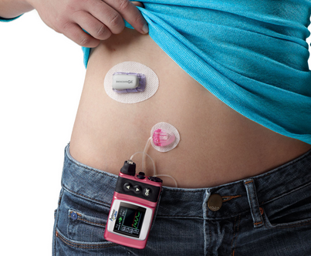
Insulinpump
En insulinpump innehåller bara snabb eller direktverkande insulin. Insulinet tillförs som en kontinuerlig subkutan infusion. Pumpen kan programmeras så att hastigheten ändras vid bestämda klockslag. Man kan också öka eller minska basdosen under några timmar om blodsockret skulle ligga högt eller lågt eller om man ska göra något speciellt (t ex motion)
Vid måltid ger man manuellt en extra snabb "bolusdos" med hjälp av pumpen på samma sätt som med en insulinpenna.
Man måste sticka sig och byta infusionsset ungefär var tredje dag.
Man kan i pumpen integrera ett system för kontinuerlig blodsockermätning (CGM) vilket ger ytterligare stora möjligheter att kontinuerligt styra sitt blodsocker genom att ge extra bolusdoser eller tillfälligt öka eller minska basaldosen. Det finns också pumpar som man kan programmera så dom stänger av sig vid hotande låga eller snabbt sjunkande blodsocker för att undvika allvarliga hypoglykemier. Mer om detta i kap 15 Blodsockermätning när var hur
Fördelar med insulinpump
Den stora fördelen med pump är att man får en större möjlighet att styra tillförseln av basinsulinet till skillnad från en eller två injektioner med basinsulin per dag. Man kan programmera pumpen så att de varierar basnivån av insulin under dygnet. Man har också möjlighet att tillfälligt sänka eller öka basdosen under en kortare tid.
Med hjälp av pumpen kan man uppnå ett jämnare blodsockerläge. Möjlighet finns att ligga lägre i blodsocker och samtidigt ha färre känningar. Detta kräver dock intresse, frekventa blodsockermätningar och kunskap. Pumpen i sig löser inga problem men kan vara ett bra hjälpmedel för den som vill förbättra kontrollen.
Patienter med nattliga känningar och höga morgonvärden kan ha extra stor hjälp av en insulinpump då det finns möjligheter att minska basinsulinet under natten för att sedan öka på dosen fram emot morgontimmarna då insulinbehovet brukar öka (gryningsfenomenet) eftersom kortisolnivåerna i blodet stiger till följd av dygnsrytmen.
Även vissa mycket insulinkänsliga patienter (med låga insulindoser) och svängigt blodsocker kan bli hjälpta av en insulinpump. Detta beror troligen på att tillförseln av basinsulin är så jämn och förutsägbar till skillnad från injektionen med subkutant insulin. Man också i pumpen dosera med dossteg på 0,1 Enhet.
Patienter som tränar mycket har stora möjligheter att variera basdoserna före under och efter träningspassen.
Nackdelar och risker med insulinpump
Den stora risken med insulinpump är den ökade risken för ketoacidos. Pumpen innehåller endast direktverkande insulin. Blir det ett läckage i infusionssetet eller om nålen halkar ut finns risk att inom några timmar bli riktigt sjuk. Däremot är risken för allvarliga känningar snarare lägre med insulinpump.
Att bära insulinpump kräver alltså större vaksamhet och oftast fler blodsockerkontroller än vanliga injektioner. Det kräver också att patienten både kan hantera tekniken (programmera pumpen) och reagera adekvat när problemen uppstår.
Vem bör erbjudas insulinpump?
I första hand används insulinpump till typ 1-diabetiker med svängande blodsocker och/eller problem med nattliga hypoglykemier eller patienter som trots idogt arbete har svårt att få ner sitt HbA1c till rimliga nivåer bör också erbjudas en pump som hjälpmedel.
Enligt Riktlinjer för insulinpumpbehandling till vuxna från Svensk förening för diabetologi föreslås att följande patienter ska erbjudas insulinpump (för detaljer se artikel i internetmedicin)
- Patienter med HbA1c över 65 mmol/mol eller HbA1c över det individuella HbA1c målet
- Gryningsfenomen med högt plasmaglukos på morgonen där problemet ej kan lösas genom justering av insulindosen till kvällen och med dokumenterade låga plasmaglukosvärden under natten(kl. 03-04)
- Upprepade episoder med insulinkoma, där ingen annan förklaring finns såsom alkoholproblem eller annan endokrin rubbning
- Hypoglykemisk omedvetenhet (hypoglykemisk unawareness) som kvarstår trots minskade insulindoser
- Patienter med lågt BMI och små insulindoser, där man har svårighet att reglera insulintillförseln utan insulinkänningar eller stora plasmaglukossvängningar
- Uttalad diabetisk gastropares med fördröjd magsäckstömning, där pumpen ger möjlighet att tillföra en måltidsdos av insulin under flera timmar (fördröjd bolus)
- Ökade möjligheter till förbättrad livskvalitet hos exempelvis en person som ofta reser mellan olika tidszoner, skiftesarbete, elitidrott
Insulinpumpbehandling vid typ 2 diabetes kan övervägas.
Vem bör inte ha en insulinpump
- Patienter med alkohol eller drogmissbruk bör definitivt inte ha en pump pga risk för både hyper och svåra hypoglykemier.
- Patienter som ej kan reagera adekvat på höga blodsockervärden med risk för ketoacidos bör avstå från pumpbehandling.
- Man måste också kunna kräva att patienten självständigt och på egen hand kan programmera och sköta pumpen rent tekniskt. Man bör aldrig förse en patient med pump som skall skötas av t ex en anhörig. (Undantag barn där vuxna ansvarar för pumpen)
Utsättning av insulinpumpbehandling
- Omprövning kring fortsatt insulinpumpbehandling görs regelbundet.
- Vid tillstånd som kan påverka förmågan att fysiskt o/e kognitivt hantera insulinpumpen, såsom vid stroke, kognitiv störning eller vid andra nytillkomna sjukdomar - bör man överväga utsättning av insulinpumpbehandling och övergå till annan insulinbehandling
- Hos patienter med upprepade episoder med ketoacidos, manipulation och bristande egenvård skall indikationen för insulinpump ifrågasättas.
Typ 2
Se även:
Algoritm Farmakologisk behandling av typ 2
Kap 11 Tabletter och andra farmaka vid typ 2
Kap 12 Insulinerna
Varför får man typ 2-diabetes?
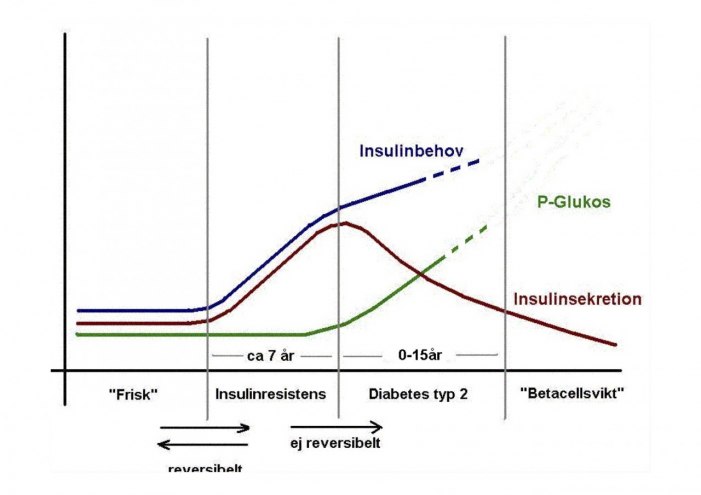
För att få typ 2-diabetes krävs att man både har en nedsatt känslighet för insulin och en störd frisättning eller produktion av insulin. Troligen finns redan strukturella förändringar i pankreas (och rubbningar i andra system) innan man kan uppmäta för höga blodsockervärden. Man kan därför ibland under en tid efter diabetesdiagnos normalisera sina blodsockervärden genom kostomläggning, motion och/eller viktnedgång genom t ex kirurgi under en tid normalisera sina blodsockervärden. I de flesta fall kommer dock blodsockret efter några år att stiga igen och så småningom blir man tvungen att ta insulinsprutor för att kompensera för en dålig produktion av insulin (betacellssvikt).
Typ 2-diabetes utvecklas ofta långsamt och ger ofta inga symtom alls. Ofta kan man ha en insulinkoncentration i blodet som ligger 4-5 gånger över en frisk mäniska! Om man rör på sig och är normalviktig är inte blodsockret heller speciellt svårt att behandla. Dessutom svänger det inte så mycket och problemet med insulinkänningar (lågt blodsocker) är mycket mindre. Det brukar uppkomma när man motionerar eller äter mindre än vanligt. Inte så ofta nattetid.
Problemet med typ 2 är ofta kombinationen av de andra rubbingarna som hänger med: Högt Blodtryck, Lågt HDL-kolesterol, högt LDL-kolesterol, höga S-Triglycerider, ökad benägenhet till proppbildning mm. Dessa rubbningar har funnits under en lång tid och om man undersöker en typ 2-diabetiker vid debut har ca 50% redan komplikationer av sjukdomen.
Vi har länge haft teorin att insulinresistens (dålig effekt av insulin på lever, muskel och fettceller) är en samlande bakomliggande orsak både till blodsockerstegringen och kardiovaskulär risk vid typ 2. Det sk "metabola syndromet". Detta har på senare ifrågasatts och man pratar mer om "inflammation" som en bakomliggande samlande orsak
Vi vet dock att insulinresistens föregår diabetessjukdomen under flera år. Till en början kan kroppen kompensera den dåliga effekten av insulin genom ökad insulinproduktion och hålla blodsockernivåerna normala. Detta brukar kallas "prediabetes" och kan påvisas genom mätning av fasteblodsocker eller glukosbelastning. Se kap 2 Diagnostiska blodglukosnivåer och HbA2c-värden.
När betacellerna inte längre orkar kompensera för det ökade insulinbehovet utvecklar patienten diabetes typ 2.
Mycket talar för att det redan vid diabetesdebuten föreligger en irreversibel dysfunktion i betacellerna. Oftast tar den sig uttryck i ett stört snabbt insulinsvar vid måltider eller en oförmåga att ytterligare öka insulinfrisättningen vid en kolhydratrik måltid som i sin tur leder till en stegring av blodsockret och blodfetterna 1-3 timmar efter måltid.
Har man utvecklat insulinresistens kan man troligen reversera detta till normal insulinkänslighet. Men när man väl utvecklat typ 2-diabetes har redan betacellerna skadats av de höga socker och lipidnivåerna och kan troligen aldrig fullt ut återfå sin funktion.
Se schematisk bild:
Vilka individer utvecklar insulinresistens ?
Vissa individer har ett medfött anlag för att utveckla insulinresistens. Varför det är så vet vi inte. Mycket forskning bedrivs för att hitta diabetesgenerna och man har kunnat identifiera vissa kandidatgener. Troligen har benägenhet för insulinresistens haft ett överlevnadsvärde i andra skeden under evolutionen.
Men det krävs fler faktorer än genetiska för att insulinresistensen skall utvecklas. Troligen spelar brist på fysisk aktivitet och övervikt stor roll. Men även faktorer som stress och kostvanor spelar troligen en stor roll.
Med ökad motion och en normal vikt i befolkningen torde diabetes typ 2 vara en betydligt mindre vanlig sjukdom. Men utvecklingen i världen går i motsatt riktning och antalet diabetiker i världen ökar.
Det förs en diskussion om följande faktorer var för sig eller tillsammans kan orsaka eller utlösa typ 2-diabetes:
- Ärftlighet (vad?)
- Positiv energibalans
- Låg fysisk aktivitet
- Abdominell fetma (lipotoxicitet mm)
- Snabba kolhydrater och vissa fettsyror (glucotoxicitet och lipotoxicitet
- Stress, depression
- Sekundärt till andra endokrina rubbningar ?
- Autoimmuna inslag ?
- Rubbningar i inkretinsystemet
- Tarmfloran
Insulinresistens är en oberoende riskfaktor för hjärt- och kärlsjukdom.
Diabetes typ 2 ökar risken för hjärtinfarkt 2-4 gånger. Det är nu visat att denna riskökning finns redan innan diabetessjukdomen brutit ut. Högt blodtryck, lipidstörning, bukfetma och mikroalbuminuri är också kopplat till graden av insulinresistens.
Den stora utmaningen vid behandling av diabetes typ 2 är alltså inte bara att behandla ett högt blodsocker. Skall vi lyckas minska risken för hjärt- och kärlkomplikationer måste vi hitta bra metoder att behandla andra riskfaktorer såsom blodtryck, lipidrubbningar, övervikt med bukfetma och rökning.
Hur kan man förklara insulinresistens för patienten?
Det är viktigt att inte skuldbelägga patienten. Han/hon har drabbats av diabetes som ett resultat av de anlag hon fötts med och av det samhälle hon lever i. Diabetes är inte självförvållad. Övervikt, stillasittande och hög ålder ökar risken för insjuknande men är inte ORSAKEN till sjukdomen. Samtidigt är det effektivaste sättet att behandla sjukdomen att minska sin fettmassa och öka sin fysiska aktivitet.
Till skillnad från diabetes typ 1 har man snarare en överproduktion av insulin (initialt upp till 4-5 gånger mer än en icke diabetiker). Insulinbristen är relativ och beror på ett ökat insulinbehov.
Genom viktnedgång, minskad fettmängd i bukhålan och ökad fysisk aktivitet kan patienten förbättra insulinkänsligheten i muskulaturen och öka upptaget och förbränningen av glukos. En vältränad muskelcell har mer än dubbelt så många insulinreceptorer som en otränad.
Genom minskat energiintag minskar fettet i buken vilket ökar leverns insulinkänslighet. Detta minskar glukosproduktionen i levern och sänker blodsockret.
En studie publicerad i Viola Obesitas 2009 visar att 8% viktnedgång för överviktiga 20-åringar kan:
- Minska fetthalten i levern 60%
- Öka insulinkänsligheten i levern med 60%
- Öka insulinkänsligheten i muskulaturen med 97%
Det finns inget läkemedel mot typ 2-diabetes som idag kommer i närheten av den behandlingseffekten
Om man redan från början tar allvarligt på livsstilsförändringar kan vissa indivder helt normalisera blodsockervärdena utan farmaka. I varje fall tidigt under förloppet.
Kost och motion med målet normalvikt (BMI < 25) och normalt midjemått (< 94 cm för män och < 80 cm för kvinnor) är förutsättningen för en optimal diabeteskontroll på kort och lång sikt. Detta gäller oavsett om vi lägger till farmaka eller ej.
För typ 2-diabetiker måste målet individualiseras mer Se kap 10 Vad är ett bra HbA1c. Tidigt i förloppet ska målet vara ännu lägre och vid hög ålder eller etablerad kärlsjukdomen kan målet ibland vara högre.
Risken för ögon och njurkomplikationer minskar med lägre HbA1c.
På samma sätt som vid typ 1 så bör HbA1c behandlas ner till ca 50 (snitt P-glukos 8) för att minimera risken för mikrovaskulära komplikationer (ögon njurar och nerver). Vid Hba1c över 60 (snitt P-Glukos 9,5) börjar risken att öka markant och vid HbA1c över 70 (snitt-P-glukos 11) ökar risken ca 4 ggr. Det finns alltså goda skäl att behandla typ 2 till så normala nivåer som möjligt om detta är möjligt. Det är viktigare ju yngre man är och ju fler år man räknar med att leva med sin sjukdom.
Lönar det sig att behandla blodsockret för att förebygga hjärt- kärlsjukdom?
Detta samband är inte lika klart. En del av orsaken är att det troligen tar 10-15 år innan man får ”nytta” av en bra blodsockerkontroll. I UKPDS-studien (1997) kunde man efter 18 år på signifikant minskad risk för hjärtinfarkt och död om man behandlade blodsockret mer intensivt (10 mol mot kontrollgrupp) under de första 8 åren efter diabetesdebut.
Sammanfattningsvis:
- Metformin bör alltid användas vd debut och pågå så länge patienten tål
- SGLT-2 hämmare och GLP1-analoger har visat sig minska risken för total mortalitet hos patienter med redan etablerad hjärt kärlsjukdom. De har också en mycket positivt effekt på vikten samt innebär ingen ökad risk för insulinkänningar.
- Glitazoner förefaller har en kardioprotektiv effekt men innebär en ökad risk för vätskeretention och blir olämpliga vid etablerad hjärtsvikt.
- DPP4-hämmare Har i studier ingen påtaglig positiv eller negativ jämfört med ”placebo” (övriga diabetesläkemedel). Teoretiskt lämpligare än insulin och SU då de är viktneutrala. Bra alternativ till Metformin vid njursvikt.
- Insulin och Sulfonylurea (SU) och insulin har i studier inte visat på några påtagliga fördelar. Tvärtom finns spekulationer kring om att den ökade risken för insulinkänningar med arrytmirisk samt viktuppgång kan vara en nackdel.
- Vid val av läkemedelsgrupp ska hänsyn tas till patientens individuella förutsättningar och eventuell samsjuklighet.
- Insulin är indicerat vid typ 2-diabetes då patienten inte uppnår målet för glukoskontroll med andra glukossänkande läkemedel samt vid bristande egen produktion av insulin.
- Vid otillräcklig effekt kan de flesta läkemedel kombineras.
Metformin är förstahandspreparatet:
Metformin påverkar insulinkänsligheten i lever och muskulatur och är förstahandsmedel vid typ 2-diabetes och övervikt och/eller det metabola syndromet. Vi vet från UKPDS-studien att metformin är en bättre behandling än SU och insulin för att förebygga hjärtinfarkt hos överviktiga typ 2-diabetiker. Alla med typ 2-diabetes rekommenderas att få Metformin som grundbehandling redan från debut. Börja med 500 mg 1x1 och titrera upp till 2x2 eller max tolererbara dos avseende mag- tarmbiverkningar.
Metformin har också fördelarna att den inte leder till viktuppgång, inte ger några allvarliga insulinkänningar i monoterapi och är billigt (ca 1,50 kr per dag).
Det finns en allvarlig risk med metformin och det är att drabbas av laktatacidos som kan uppträda vid metforminbehandling om man samtidigt får annan akut sjukdom med sämre perifer cirkulation och/eller njursvikt (t ex magsjuka).
Om inte Metformin räcker till
Tidigare rekommenderades insulin och SU-preparat i tillägg. Dessa har dock två uppenbara nackdelar. Risk för hypoglykemier och viktuppgång. Istället finns idag möjlighet att använda nya läkemedel gärna i lägre doser och i olika kombinationer med varandra innan vi överväger att sätta in insulin:
SGLT-2 hämmare
Forxiga, Invokana och Jardiance påverkar specifikt ett transportprotein (SGLT2) i njuren och leder till en utsöndring av ca 70 g glukos per dygn. De förmår sänka Hba1c 5-13 mmol/mol och leder till ca 2-4 kg viktnedgång. De har en lätt diuretisk effekt och sänker blodtrycket något. Biverkningar i studier är ökad förekomst av svamp i underlivet och ökad frekvens av urinvägsinfektioner. Preparatet leder inte till några allvarliga hypoglykemier.
Effekten är beroende av en fungerande njure (eGFR > 45) men oberoende av insulin. Typ1-diabetes dock en kontraindikation pga risken för normoglykem ketoacidos
I kardiovaskulära säkerhetsstudier har Jardiance och Invokana minskat risken för kardiovaskulär död med över 30%. Effekten är troligen en gruppeffekt men rekommendationen är att ge Jardiance som förstahandspreparat i tillägg till metformin vid etablerad hjärt/kärlsjukdom, eGFR > 45 och ålder biologisk ålder under 85 år.
I samma studier visas på minskad progress av diabetesnefropati samt minskad risk för inläggning på sjukhus pga hjärtsvikt.
Utmärkt att kombinera med DPP4-hämmare, GLP1-analog och eller pioglitazone samt naturligtvis även SU, repaglinide och insulin.
GLP-1-analoger
Det finns flera kroppsegna peptider som bildas och frisätts från tarmen när vi äter (sk inkretiner). GLP-1, PPY och GLIP bl a. De har flera effekter i kroppen. Delvis påverkar de pankreas så att insulin frisätts och glukagonfrisättningen bromsas, delvis ökar de mättnadskänslan genom att bromsa ventrikeltömningen. Finns också uppgifter om att de kan påverka mättnadscentrum i hjärnan.
Byetta, Bydureon, Lyxumia, Trulicity, Victoza och Ozempic är GLP-1-analoger som inte bryts ner av enzymet DPP4 med samma hastighet. De injiceras subkutant och förmår sänka HbA1c 8-19 mmol/mol och leder till 2-4 kg viktnedgång (i studier). En annan stor fördel är att de inte ger upphov till insulinkänningar.
I kardiovaskulära säkerhetsstudier har Trulicity, Victoza och Ozempic dessutom kunnat visa på minskad risk för kardiovaskulär död, hjärt eller stroke hos patienter med etablerad hjärt/ kärlsjukdom.
Kan kombineras SGLT-2-hämmare, pioglitazone, SU, repaglinide och insulin.
DPP4-hämmare
Kroppseget GLP-1 och GLIP bryts snabbt ner av ett enzym om heter DPP-4 (Di-Peptidyl-Peptidas 4). DPP4-hämmare minskar effekten av detta enzym och leder till ökad effekt av kroppens egna inkretiner.
Januvia, Galvus, Onglyza och Trajenta förmår sänka HbA1c ca 7-8 mmol/mol. De betraktas som viktneutrala. De finns i tablettform och leder inte till samma illamående som GLP-analogerna. Säkerhetsstudier finns som inte visar på någon ökad risk för hjärt/kärlsjukdom. Undantag möjligen för Onglyza där SAVOR-studien talar för en viss ökad risk för inläggning på sjukhus för hjärtsvikt.
Kan användas vid terminal njursvikt.
Tillför inget extra i kombination med GLP1-analog men kan gärna kombineras med SGL-2-antagonist, pioglitazone, SU, repaglinide eller insulin.
Pioglitazone
Pioglitazone lanserades år 2000 under namnet Actos. Det är ett läkemedel so påverkar uttrycket av en gen i fettväven (PPAR-gamma) som indirekt påverkar insulinkänsligheten i levern. Har också positiv effekt vid sk NASH (leversteatos pga övervikt). Preparatet kom i vanrykte 2007då en metaanalys gjordes som visade på att ett liknande preparat (rosiglitazone Avandia) misstänktes ÖKA risken för hjärt och kärlsjukdom. Detta visade sig sedan inte stämma i riktiga randomiserade studier. Tvärtom har troligen glitazonerna en skyddande effekt på hjärt kärlsjukdom jämfört med SU och insulin som man då jämförde med.
Det har också spekulerats i om glitazonerna kunnat orsaka blåscancer. Denna misstanke är numera (2017) avskriven. En viss ökad risk för frakturer hos kvinnor föreligger.
Problemet med glitazonerna är risken för vätskeretention (speciellt i kombination med insulin). Så de är olämpliga att använda vid hjärtsvikt och maculaödem. Ibland kan en hjärtsvikt demaskeras med symtom när man sätter in en glitazone.
Pioglitazone är ett mycket effektivt läkemedel vid nedsatt insulinkänslighet och kan kombineras med samtliga övriga läkemedel.
Sulfonylurea och repaglinide
Sulfonylurea började användas under efterkrigstiden. Preparaten stimulerar pankreas att frisätta insulin och fungerar bara om man har en fungerande insulinproduktion och fungerar därför inte vid typ 1-diabetes eller efter många års diabetes med typ 2. Tidigt i förloppet är SU effektivt och sänker HbA1c ca 10 mmol/mol. Nackdelar är viktuppgång 2-4 kg samt risk för insulinkänningar. Många SU-preparat har en lång halveringstid och är förenade med risk för långdragna insulinkänningar, främst hos äldre med nedsatt lever och njurfunktion. De leder också till en viss viktuppgång (ca 2 kg).
Ett mer kortverkande alternativ är Repaglinide (Novonorm) som man tar till de måltider som leder till stigande blodsocker. Risken för hypoglykemier och viktuppgång är teoretiskt mindre men inte tillräckligt studerat.
Kliniskt yttrar sig detta som postprandiella blodsockerstegringar (stigande blodsocker efter en kolhydratrik måltid). Om man mäter P-Glukos före och 1½-timme efter måltid stiger det markant (ofta 4-5 mmol/l).
Insulinbehandling vid typ 2
Att använda insulin som andrahandsval efter metformin vid typ 2-diabtes är ofta inte logiskt och innebär en hel del problem:
- Vid intensiv insulinbehandling ökar vikten med 2 kg för varje 10 mmol/mol som HbA1c sänks!
- Insulinbehandling kräver stora kunskaper hos patienten och planering av vardagen för att få ett jämnt blodsocker och undvika höga värden och låga värden (hypoglykemier)
- Risken för hypoglykemier innebär att man har svårare att nå sina målvärden och risk för skyddsätning som leder till viktuppgång
- Insulinbehandling kräver tätare uppföljningar och tid från diabetessköterska. Tid som skulle kunna användas till gruppundervisning, motionsgrupper, förebyggande arbete mm.
- Insulin i sig är relativt dyrt och kräver tätare uppföljningar av diabetessköterskorna. Tid som skulle kunna användas till gruppundervisning, undervisning och uppföljning.
Samtidigt är insulin en mycket effektiv behandling som innebär att man alltid kan få ner blodsockret om man bara höjer dosen tillräckligt mycket. Indikation för insulinbehandling är:
- Vid högt och symtomgivande blodsocker vid debut kan behövas en övergående insulinbehandling för att normalisera blodsockret.
- Vid tecken på insulinbrist efter många års diabetes typ 2 (sjunkande vikt och stigande blodsocker)
- Vid samtidig pankreassvikt
- Vid terapisvikt på ovanstående preparat
- Vid högdos kortisonbehandling
- Vid annan akut sjukdom (svåra infektioner, gangrän etc)
NPH (Humulin NPH, Insuman basal, Insulatard) till natten.
Sedan slutet på 90-talet har denna behandlingsregim varit mycket använd vid terapisvikt med metformin och förhöjda fastevärden. Man börjar med 6-10 enheter och ökar dosen med 2-4 E var tredje dag tills målvärdet fastande på morgonen uppnåtts (< 7 mmol/l).
Om problem med nattliga hypoglykemier kan man byta till en långverkande analog (Abasaglar, Lantus, Toujeo)
Vid otillräcklig effekt dagtid kan man lägga till en dos NPH på morgonen, gå över till en mer långverkande analog och/eller börja med måltidsinsulin om blodsockret stiger signifikant efter en kolhydratrik måltid.
NPH i en eller tvådos
Vi höga värden dagtid under tid på dygnet man äter (gäller ofta äldre med många års diabetes) är det bättre att börja med en dos NPH. Man garanterar då insulin under dygnets vakna timmar och minimerar risken för nattliga hypoglykemier. Om blodsockret sedan stiger under kvällen och natten kan man lämpligtvis lägga till en dos till på eftermiddagen eller byta till en långverkande analog.
Om man trots detta har höga värden 1-2 timmar efter måltider kan man ge ett direktverkande insulin inför dessa måltider.
Mix-insulin i en, två eller tredos
Mixinsulin är en fast blandning på 25, 30 eller 50 % direktverkande insulin och resten NPH-insulin. Mixinsulin kan användas som en kompromiss om man vill ha en basal/bolusregim där patienten har fasta doser och har svårt att hålla reda på mer än en insulinsort. Dosen ges till huvudmålen 1,2 eller 3 gånger per dag. Regimen kräver regelbundna tider och man äter ungefär samma mängd kolhydrater till sina fasta måltider från dag till dag. Man måste också försäkra sig om att dosen ges direkt i anslutning till en måltid. Det finns ingen flexibilitet och ställer till problem om en patient inte vill äta en måltid. Om ger dosen fons stor risk för känning. Om man reducerar dosen eller inte ger den kommer man att sakna den nödvändiga bas-dosen.
Algoritmer för insättning och dostitrering: Se bilaga Typ 2 –algoritmer för blodsockerbehandling
MODY (Monogen diabetes)
Monogen diabetes eller MODY (Mature Onset of Diabetes in the Young) beror på en mutation i en gen och är dominant ärftligt (Om man har anlaget är risken 50% att ens barn ska ärva den).
Karaktäriseras av mild hyperglykemi, tidig diagnos (0-30 år) eller debut som graviditetsdiabetes, och god insulinkänslighet. MODY kännetecknas av bukspottkörtelns termostat är felställd och börjar frisätta insulin vid högre P-Glukos än hos friska. Det leder till en mild hyperglykemi som kan behandlas med kost. Om kostbehandling inte räcker till kan SU eller repaglinid övervägas. SGLT-2 hämmare borde vara effektiva medan metformin, pioglitazon, GLP-RA eller DPP4-hämmare fungerar dåligt. MODY 2 (glucokinasdefekt) är den vanligaste i Sverige och denna försämras inte med åren och är inte förknippad med diabeteskomplikationer. Vissa andra MODY-typer är progressiva och patienten bli beroende av tabletter och så småningom även av insulin.
Troligtvis finns en hel del fel diagnostiserade patienter. Enstaka barn som insjuknar i diabetes kan per automatik få diagnosen typ 1 och i värsta fall fortsätter dom med en onödig insulinbehandling resten av sitt liv. Det finns troligen också en del som fått diagnosen typ 2 patienter som uppvisat högre blodsocker vid screening, vid kontroll på en kompis blodsockermätare eller vid uppföljning efter graviditetsdiabetes.
Pankreasinsufficiens
Klassisk kombinerad endokrin och exokrin pankreasinsufficiens leder till diarréer, fettmalabsorption, viktnedgång och en typ 1-liknande diabetes.
Vanligaste orsaken är genomgångna pankreatiter (alkohol, gallstensutlösta, celiaki och inflammatorisk tarmsjukdom). Patienten har inte alltid minne av en pankreatit och i vissa fall kan de säkert ha gått förbi relativt symtomlösa. Den kan naturligtvis också bero på kirurgiskt avlägsnande av hela eller delar pankreas. Det finns också sällsynta former som t ex Hemokromatos, Wilsons sjukdom och alfa 1-antitrypsin brist.
Vid pankreasinsufficiens har man en absolut insulinbrist och förstahandsval är insulin. Speciellt om patienten har svårt att hålla vikten. Undvik tabletter som antingen inte har någon effekt eller ökar diarréproblematiken. Ofta är patienterna väldigt insulinkänsliga och svänger kraftigt i blodsocker pga samtidig brist på glukagon vid låga blodsocker och näringsbrist (glykogenbrist).
En energirik kost är viktig. Ofta tål man inte för mycket fett. Dessutom är det viktigt med regelbundna måltider. Patienten ska behandlas med Creon vid diarréer.
Basinsulin och måltidsinsulin
Mest fysiologiskt och störst chans att styra blodsockret är att använda sig av basinsulin och måltidsinsulin. Patienterna är ofta insulinkänsliga och har ett svängande blodsocker.
Mixinsuliner.
- Novomix 30 och Humalog mix 25: Börja med 6-8 E till frukost. Om fortfarande stigande under dagen öka med 2-6 E per vecka. Om stigande efter kvällsmaten fram till läggdags och höga fastevärden lägg till en dos till huvudmålet på em eller kväll.
- Humalog mix 50: Innehåller 50 procent direktverkande och 50% NPH-insulin. Kan med fördel ges till varje huvudmål under dagen. Börja med 4 E till varje måltid. Öka med 2-4 E per vecka. Om höga fastevärden. Kombinera med Metformin och/eller NPH-insulin till natten.
Alkoholism och missbruk
Alkohol
Egentligen finns ingen bra farmakologisk behandling när man missbrukar alkohol. Patienterna ser också väldigt olika ut. Olika alkoholskador ger också upphov till olika sorts diabetes.
- En del alkoholister har haft upprepade pankreatiter som gör dom insulinberoende (se ovan) och de ska då naturligtvis behandlas med insulin.
- Alkohol leder till bukfetma och leversteatos och därmed ett svårbehandlat insulinsresistenssyndrom. Dold alkoholöverkonsumtion är ett stort problem som man alltid ska överväga hos svårbehandlade överviktiga typ 2-diabetiker. Metformin är då förstahandspreparat men innebär också en risk för laktatacidos.
- Periodiskt missbruk där patienten periodvis slutar äta helt och bara försörjer sig på alkohol leder till speciella problem.
Alkohol leder under tiden alkoholen bryts ner i levern till att blodsockret sjunker (bromsar nybildningen av socker i levern). Insulinbehandling kan innebära en stor risk för hypoglykemier. Speciellt om patienten enbart dricker alkohol och inte äter några kolhydrater.
Metformin är lämpligt till överviktiga patienter med leversteatos men kan leda till laktacidos om man dricker stora mängder utan att äta under flera dagar
SU-preparat kan leda till svåra hypoglykemier vid en rejäl fylla. Kanske är det lämpligare att använda kortverkande insulinfrisättare (Repaglinide) men erfarenhet saknas. Man måste tänka på att insulinfrisättare inte fungerar vid samtidig pankreasinsufficiens (nedsatt insulinproduktion)
Pioglitazone: Inga studier eller erfarenheter finns.
GLP-analoger och DPP4-hämmare: Inga studier eller erfarenheter finns.
SGLT2-antagonister: Inga studier eller erfarenheter finns.
Man måste alltså försöka behandla den typ av diabetes de har och sätta det i relation till riskerna. Någon bra behandling förutom att avstå från alkohol finns inte.
Annat missbruk
Här finns ju en mängd olika droger. Speciellt besvärligt brukar missbruk av amfetamin vara. Under missbruksperioden äter patienterna i stort sett ingenting med risk för känningar. När dom sen tänder av kan dom ibland äta kopiösa mängder mat och har ett kraftigt sug efter snabba kolhydrater. Insulinbehov kan vara i det närmaste omättbart.
Kortisonbehandling i högdos
Höga doser kortison kan utlösa en typ 2-diabetes. I vissa fall normaliseras blodsockervärdena när man slutar äta kortison. Rör det sig bara om en kortvarig kur och lätt stegrade värden utan symtom kan man därför avvakta.
Planeras långtidsbehandling med höga doser och blodsockervärden över 10-15 krävs oftast insulin, i varje fall tillfälligt.
Ofta behöver tablettbehandlade tillfälligt behöva insulin vid en kortisonkur.
Insulinbehandlade behöver ofta kraftigt öka sina insulindoser (vid höga doser kortison ibland behöva mer än dubbel dos.
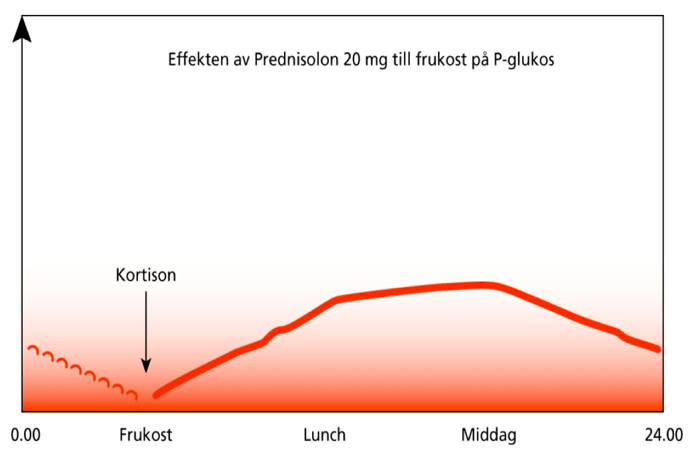
När skall P-Glukos kontrolleras?
Tillför man en högdos kortison ( t ex 20 mg Prednisolon) på morgonen stiger P-Glukos långsamt under dagen till ett max efter ca 8 timmar för att sedan sjunka under kvällen under natten. För att kontrollera om kortisonet ger upphov till en kliniskt relevant blodsockerstegring skall P-Glukos därför kontrolleras ca 8 timmar efter intagen dos (före kvällsmat/middag).
När skall insulin ges?
Oftast bör man inleda behandling med ett mixinsulin eller NPH-insulin till frukost. Ibland behövs även en dos på lunch eller vid kvällsmaten eller något måltidsinsulin till lunch och kvällsmat.
- Humalog mix 25/Novomix 30 eller NPH-insulin: Börja med 6-8 E till frukost. Om fortfarande stigande under dagen (till middagsmålet) öka dosen med 2-6 E per gång. Om stigande efter kvällsmaten fram till läggdags och höga fastevärden lägg till en dos till huvudmålet på em eller kväll. Alternativt kan man lägga till måltidsdoser under dagen.
- Humalog mix 50: Innehåller 50 procent direktverkande och 50% NPH-insulin. Kan med fördel ges till varje huvudmål under dagen. Börja med 4 E till frukost och lunch. Öka med 2-4 E per vecka. Om höga fastevärden: Ge även Humalog mix 50 till kvällsmaten eller kombinera med Metformin och/eller NPH
Om man redan står på flerdos är det framförallt frukost och lunchdosen som behöver ökas med målet att inte stiga till lunch och middag. Man kan också lägga till en exra dos långverkande insulin på morgonen eller höja en befintlig morgondos långverkande insulin. Ibland kan alla doser behöva höjas.
Mät blodsocker minst före frukost, före middag/kvällsmat och till natten.
För mer detaljer och utskriftsvänliga sidor:
bilaga kap 18: patientinformation: Kortisonbehandling i högdos
bilaga kap 18: Diabetesbehandling vid kortisonbehandling i högdos
Polycystisk Ovariesjukdom PCO
PCO-syndromet kännetecknas av övervikt, amenorré, ökad (manlig) behåring och diabetes typ 2. Oftast ställs diagnosen i samband med infertilitetsutredning eller utredning av uteblivna menstruationer.
Det viktigaste inslaget i behandlingen är viktnedgången (kost och motion). Detta förbättrar blodsockerläget och minskar fettprocenten. Fettcellerna är endokrint aktiva såtillvida att de omvandlar östrogen till testosteron vilket leder till ökad manlig behåring, amenorré och barnlöshet.
Vid dålig blodsockerkontroll och graviditetsönskan kan behandling med metformin och/eller insulin prövas. Metformin avrådes normalt under graviditet pga ofullständiga data rörande påverkan på fostret. Metformin klassas som kategori B2 (ofullständiga undersökningar i djurstudier) men de studier som genomförts har ej påvisat fosterskador. Metformin är ett gammalt preparat och inga uppgifter finns om fosterskador från de kvinnor som av misstag intagit metformin tidigt i graviditeten. I flera länder (Australien) behandlas graviditetsdiabetes med metformin. Däremot bör man undvika andra perorala antidiabetika.
Om graviditetsönskan inte finns kan man behandla som en vanlig typ 2-diabetes. Men innan andra perorala antidiabetika än metformin prövas bör man försäkra sig om att patienten vidtar fullgoda åtgärder mot graviditet.
Skulle patienten ändå bli gravid under pågående behandling med andra preparat bör dessa omedelbart ersättas med insulin. Någon indikation för abort finns dock inte då risken för fosterskador är mycket små.